Bijvoet Centrum (2): Een medicijn voor taaislijmziekte

Een belangrijk onderzoeksthema van het Bijvoet Centrum is eiwitten. Als eiwitten niet de juiste vorm hebben, kunnen ze hun werk niet doen en veroorzaken ziektes. Post-doc Bertrand Kleizen is dicht bij een doorbraak naar een oplossing voor de vouwingsziekte cystic fibrosis (CF) ofwel taaislijmziekte. Deel 2 in de serie over het Bijvoet Centrum.
Verreweg de meeste activiteiten in onze lichaamscellen worden uitgevoerd door eiwitten. Zij kunnen hun werk echter alleen goed doen wanneer ze in de juiste driedimensionale vorm zijn gevouwen. Ziektes als Alzheimer en verschillende soorten kanker zijn mede het gevolg van vouwingsfouten. De vouwingsziekte cystic fibrosis (CF) ofwel taaislijmziekte is een aandoening waaraan patiënten gemiddeld rond het veertigste levensjaar overlijden. Dit past binnen het Bijvoet Centrum voor Biomoleculair Onderzoek dat onderzoek doet naar de manier waarop biomoleculen in het lichaam functioneren, zoals te lezen is in deel 1 van onze serie.
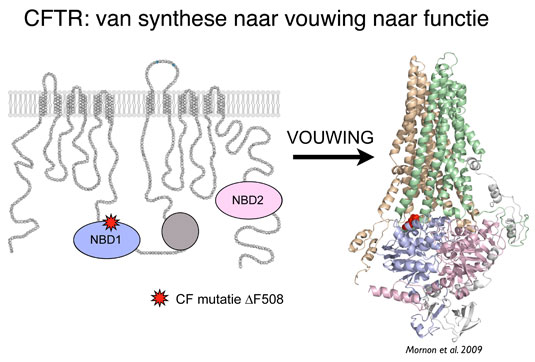
 Bertrand Kleizen: “Het probleem bij cystic fibrosis zit in CFTR, een groot eiwit dat is opgebouwd uit 1480 aminozuren. Het zorgt aan het celoppervlak voor het transport van chloride uit onze lichaamscellen. Patiënten met CF hebben een genetisch defect waardoor het eiwit in de meeste gevallen niet op de juiste manier gevouwen kan worden. Nu worden veel eiwitten direct na hun ‘geboorte’ in wat wij de vouwingsfabriek van de cel noemen, onderworpen aan een scherpe kwaliteitscontrole. Eiwitten die niet goed zijn gevouwen, worden door andere eiwitten, de chaperonnes, herkend, geholpen, en wanneer ze echt niet kunnen vouwen, zonder pardon afgebroken.
Bertrand Kleizen: “Het probleem bij cystic fibrosis zit in CFTR, een groot eiwit dat is opgebouwd uit 1480 aminozuren. Het zorgt aan het celoppervlak voor het transport van chloride uit onze lichaamscellen. Patiënten met CF hebben een genetisch defect waardoor het eiwit in de meeste gevallen niet op de juiste manier gevouwen kan worden. Nu worden veel eiwitten direct na hun ‘geboorte’ in wat wij de vouwingsfabriek van de cel noemen, onderworpen aan een scherpe kwaliteitscontrole. Eiwitten die niet goed zijn gevouwen, worden door andere eiwitten, de chaperonnes, herkend, geholpen, en wanneer ze echt niet kunnen vouwen, zonder pardon afgebroken.
“Dat gebeurt ook bij de meest voorkomende mutatie (ongeveer 90% van de CF patiënten) waarin het ontbreken van slechts één van de 1480 aminozuren, phenylalanine 508, leidt tot een verkeerd gevouwen CFTR-eiwit. Bij deze CF-patiënten ontbreekt dat eiwit dus aan het celoppervlak, waardoor hun cellen te weinig chloride ‘exporteren’ en daardoor te weinig water uitscheiden . Zij produceren dan dik, taai slijm, wat met name funest is voor het functioneren van darmen en longen.”
In het kader van zijn promotieonderzoek keek Kleizen in detail naar de vouwing van CFTR in de cellulaire vouwingsfabriek. Hij kon daardoor exact vaststellen op welk moment tijdens de vorming van het mutante eiwit de vouwingsfout begint. “Wij zijn er als eersten in geslaagd om de vorming van het CFTR eiwit dertig minuten lang van begin tot eind te volgen. Daardoor kunnen we al in de fase dat het wordt gevormd, zien hoe de fout ontstaat en mogelijk ook ingrijpen.”
Van collega-onderzoekers kreeg Kleizen onlangs de beschikking over stofjes die het verkeerd gevouwen CFTR zouden kunnen stabiliseren. Kleizen: “Je kunt hun werking het best vergelijken met een spalk langs een gebroken been, waardoor je toch een beetje kunt lopen. Wij, en ook anderen in het veld, onderzoeken nu welke van die stofjes de juiste ‘spalken’ zijn voor het ziekmakende CFTR-eiwit en het lijkt erop dat er een is gevonden. Bovendien heeft ons recente werk in Utrecht, maar ook dat in andere labs, duidelijk gemaakt dat je op verschillende manieren het genetisch defecte CFTR eiwit toch een beetje kunt laten vouwen. Het is dan weliswaar kreupel, maar de chaperonnes laten een deel ervan toch naar het celoppervlak gaan. En dat is voldoende, want zelfs als maar tien tot twintig procent van de CFTR-eiwitten het celoppervlak bereikt, kan dat de patiënt al enorm helpen.”
Recent is een klinische trial opgezet met een combinatie van twee geneesmiddelen waarvan één de vouwing en de ander de functie van mutant CFTR verbetert. Op dit moment wordt het bij de eerste patiënten uitgeprobeerd en tot vreugde van Kleizen lijkt het de longfunctie te verbeteren. “Ik ben ervan overtuigd dat we nu voor het eerst het bewijs hebben dat de erfelijke ziekte cystic fibrosis binnen afzienbare tijd kan worden behandeld met een medicijn. Fantastisch natuurlijk, want dat is waarvoor je dit soort onderzoek doet. Of ik niet bang ben dat ik mezelf nu overbodig heb gemaakt? Absoluut niet. Er is nog zoveel dat we niet over eiwitvouwing weten. Er is hier nog voor vele jaren werk.”
Een lekker eitje
Ook het feit dat een hardgekookt ei zo goed smaakt, is te danken aan een vouwfout. Een verkeerde vouwing heeft namelijk niet alleen tot gevolg dat het eiwit niet meer biologisch actief is of niet de juiste plek in de cel bereikt. Foutief gevouwen eiwitten blijven ook vaak aan elkaar plakken en dat is precies wat er gebeurt bij het verhitten van eieren. Door de hoge temperatuur veranderen goed gevouwen eiwitten in verkeerd gevouwen eiwitten die samenklonteren tot het eiwit in ons gekookte eitje.